Технология клееных стеклопакетов
|
Пороки, вызванные химическим взаимодействием стекла Вопрос о химической устойчивости может рассматриваться только с точки
зрения готовых изделий: при их переработке, хранении или применении. В
подавляющем большинстве случаев наиболее актуальными являются нежелательные
реакции стекла с водой. Дополнительное влияние могут оказывать и такие
компоненты атмосферы, как углекислота, оксид серы, оксид азота, специальные
продукты испарения или горения, сопутствующие производству. Причины химической активности поверхности стекла FSi = VSiO2 : (VМе2О + VМеО + 3VМе2О3 + 2VМеО2 + 5VМе2О3 + 3VМеО3) Для структуры чистого кварцевого стекла, состоящего целиком из тетраэдров
[SiO4], каждая из кислородных вершин является общей для двух соседних
тетраэдров. Каждая молекула SiO2 состоит из одного иона кремния и четырех
равноотстоящих от Si4+ половинок двухсвязных ионов кислорода. При введении
в кварцевое стекло оксидов Ме2О или МеО одна вершина у части (SiO4)-тетраэдров
“ослабляется”, т.к. по соседству с ионами кислорода оказываются ионы Ме2+,1+,
обладающие более слабым полем, чем Si4+. Количество таких тетраэдров возрастает
по мере увеличения содержания в стекле Ме2О и МеО. Этот процесс изменения
структуры кремнекислородного каркаса и находит свое отражение на свойствах
SiO2 в стекле, а следовательно, и самого стекла. От степени связности
кремнекислородного каркаса зависит состояние структурного кислорода в
стекле, его активность. По теориям Захариасена и Уоррена сетка тетраэдров
SiO2 разрывается встраиванием ионов натрия или кальция, причем разрыв
происходит по немостиковым ионам кислорода. В процессе формования стекла
большое количество щелочных ионов оказывается на поверхности стекломассы.
Эта “незанятая щелочь”, количество которой вследствие медленного отжига
может увеличиваться (ионы Ме поступают из внутренних слоев стекла), а
также “немостиковые” ионы кислорода являются главной причиной химической
реакционной способности поверхности стекла. На рис. 1 относительные размеры
кружков указанных ионов соответствуют приблизительно соотношению ионных
радиусов. 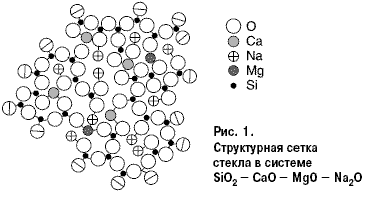 Восьмерная координация кальция, четверная — магния, включая два иона натрия, необходимые для уравнивания валентности, обозначены в виде роеобразования. Проекцией на плоскости каждый тетраэдр становится треугольником, каждый октаэдр — четырехугольником. Ионы кислорода, находящиеся на границе сетки, разделены пополам. Если представить себе, что правая граница схемы — поверхность, то видно, что при пяти молекулах кремнезема с немостиковыми ионами кислорода два щелочных иона энергетически готовы к химическому взаимодействию. Принцип химического взаимодействия стекла при участии воды Все химические изменения поверхностей стекла следует понимать, как реакции концевых элементов стекла с ненасыщенной валентностью, таких как кремний или координационно незанятые натрий и калий. Для свежих поверхностей стекла, например, после его разрушения, мостиковая связь между ионами кремния нарушается, и образуются два различно заряженных нестабильных “радикала”:
Эти “радикалы” проявляют большую реакционную способность к молекулам
среды, в которой они находятся, особенно воды: 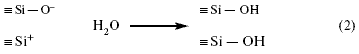 Это означает, что в обоих случаях атом кремния соединяется с группой ОН. Реакцию (2) можно представить в следующем виде:
Группировку Si — OH называют силанол. Из реакции (2) можно проследить
образование мостикового кислорода: Силанольные группы химически реакционноспособны: ион водорода Н относительно легко передвигается (более подвижными являются щелочные ионы, связанные с кислородом, такие как натрий, литий) и может заменяться другими соединениями. На поверхности стекла могут таким способом появляться другие оксиды и при известных условиях целые слои. Затем адсорбируются молекулы воды, образуется состояние равновесия с водяными парами окружающей атмосферы. Химически связанный слой воды имеет толщину 10-10 см и называется “постоянный гидратированный поверхностный слой”, в противоположность “временному гидратированному поверхностному слою”, который адсорбируется физически равновесно в зависимости от содержания влаги в воздухе и имеет толщину приблизительно 10-7 см. Химическое взаимодействие поверхности стекла с другими компонентами происходит всегда при участии воды или продуктов ее разложения: Количественная связь этого уравнения дается константами равновесия по закону действующих масс:
Это означает, что в водном растворе концентрация ионов водорода Н+ должна увеличиваться, если концентрация ионов ОН– уменьшается, и наоборот. Механизмы водной (гидролитической) и кислотной коррозии очень сходны: в обоих случаях происходит воздействие на катионы-модификаторы, особенно на реакционноспособные щелочные ионы.
Оба уравнения показывают, что ион натрия менее прочно связан с кислородом,
чем ион водорода. На этом факте основаны процессы ионного обмена в водных
растворах, известные как выщелачивание. 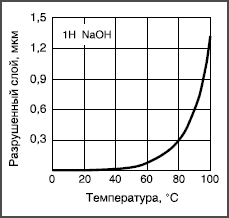 Рис. 2. Температурная зависимость растворимости боросиликатного стекла в 1 Н растворе NaOH. Если гидролитическая и кислотная коррозия в обычных стеклах незначительна, то щелочные растворы сильно разъедают почти все стекла, растворяя даже их сетку. Интенсивность коррозии экспоненциально увеличивается с концентрацией щелочи и с температурой (рис. 2). Причина такой интенсивности щелочной коррозии заключается в том, что гидроксильные группы ОН могут расщеплять кислородную мостиковую связь между двумя ионами кремния:
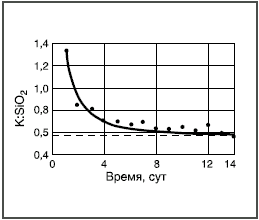
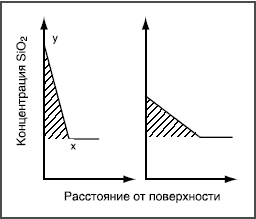
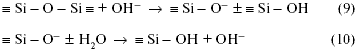 Здесь реагируют не возникающие группы, а разрушается внутренняя сетчатая структура, т.е. стекло растворяется. Например, кремнезем в щелочных растворах переходит в растворимый силикат, алюминий — в алюминат и т.д. Пороки химического происхождения на поверхности стекла Избыток воды 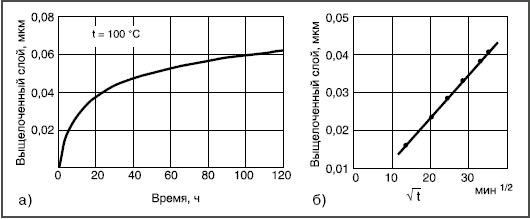 Толщина выщелоченного слоя рассчитана из количества выделившегося Na2О. Выщелачивание поверхности пропорционально времени t1/2. Графическое изображение зависимости количества выщелоченного материала от времени в начале имеет вид параболической кривой (рис. 3а). Если же на оси абсцисс отложить t1/2, то зависимость — прямолинейная (рис. 3б). При длительном гидролитическом воздействии устанавливается равновесие между поверхностью стекла и водной средой, и процесс растворения прекращается (рис. 4 и 5). Это является общей закономерностью процесса выщелачивания всех видов стекол, растворяющихся не полностью.
По завершении реакции с находящимися на поверхности щелочами взаимодействие
переносится в нижележащие слои, преодолевая препятствие силикатной решетки,
а следовательно, дальнейший процесс является диффузионным. Скорость диффузии
при низких (примерно до 80°С) температурах сравнительно мала. В соответствии
с уравнением (2), на поверхности образуются группы силанола. Этот процесс
происходит тем интенсивнее, чем большее количество щелочей содержит стекло.
Слой, образовавшийся в процессе реакций, при этом постепенно утолщается.
Соответственно увеличиваются пористость и площадь поверхности. Такая поверхность
способна адсорбировать воду и физическим путем в результате действия капиллярных
сил, причем выщелоченные поверхностные слои разбухают. Они получили собственное
название: слой геля кремнекислоты. С химической точки зрения они идентичны
защитным слоям.
Если поверхность стекла взаимодействовала не с химически чистой водой (т.е. дистиллированной), а с обычной водопроводной, то при высушивании в осадке обнаруживаются следы примесей элементов, определяющих жесткость воды — карбонатов Са и Мg. Если такую поверхность подвергнуть высушиванию при 120°С, то примеси могут интенсивно реагировать со стеклом вплоть до образования пятен. Обычными способами очистки и даже кислотами удалить их не удается. Недостаток воды
Наглядный пример гидролитической реакции, идущей при недостатке воды, — действие влаги, сконденсировавшейся между прилегающими друг к другу в стопе листами стекла, в результате чего в дальнейшем может образоваться порок. Расчет показывает, что при охлаждении 1 м3 воздуха, насыщенного влагой, с 35 до 25°С может выделиться 7,5 г воды. Капля воды массой 50 мг растечется по поверхности листа стекла на площади примерно в 50 см2 (при толщине слоя 0,05 мм). В этих условиях вполне могут происходить описанные ранее реакции, которые на первой стадии дают пятна разъедания. При определенных условиях они могут быть прозрачными. При длительном взаимодействии поверхностей стекла, сопровождающемся конденсацией, разъеданием, испарением и т.д., образуется соединение типа натриевого растворимого стекла:
В итоге этого процесса взаимодействие поверхностей стекол может быть столь интенсивным, что при попытке их разъединения стекло разрушится. Потери стекла из-за склеивания имеют место в тех случаях, когда упакованные для длительного хранения или транспортировки листы стекла тесно соприкасаются. Сказанное поясняет кажущееся парадоксальным положение, что листовое стекло, абсолютно надежное в остеклении, оказывается в опасности в условиях длительного хранения в упакованном виде. При гидролитическом действии с недостатком влаги (за большие промежутки времени) и взаимодействии с углекислотой воздуха вероятно полное извлечение СаО из стекла в виде растворимых гидрокарбонатов. Гидролитическое действие может быть уменьшено применением активных сред или благодаря образованию защитных слоев силикагеля. Это также может произойти, если в результате взаимодействия с атмосферой воздуха образуются новые соединения типа кальцита или гипса (СаSO4:). Если после гидролитического действия при недостатке влаги продукты реакции отводятся из поверхностных слоев избытком влаги (дождь), то обычная гидролитическая реакция вызовет образование слоя геля кремнекислоты. Создается набухший слой, который вследствие колебаний температуры и влажности воздуха дегидратируется вновь и со временем, изменяясь химически и физически, достигает видимой глазом толщины, когда ее размер превышает 1/4 длины волны видимого света: тогда видны тонкие пленки, имеющие радужную кайму. Окраска возникает вследствие явления интерференции видимого света на разрушенных поверхностных слоях. Первые признаки разрушения — слабое снижение светоотражения по сравнению с неразъеденной поверхностью, которое имеет легкую окраску (от серого до коричневого цвета). При дальнейшем утолщении слоя появляются, например, “голубые пятна” (рис. 11). По мере интенсификации гидролиза слой рассеивает свет сильнее и, наконец, становится белым. Большей частью он имеет вид облачного или пятнистого помутнения, а в экстремальных случаях слой может отслаиваться чешуйками.
Поверхностные гидролизованные слои состоят из силикагеля,
который при отводе продуктов реакции непрерывно изменяется (внешний вид
слоя аналогичен полученному при гидролитической обработке с избытком воды);
если продукты реакции не удаляются, то они осаждаются или в толще слоя,
или на его поверхности. Глубина пор в таком теле SiO2 составляет 50-120
A°. Наличие открытой структуры пор может быть доказано тем, что при внесении
в слой красителей его цвет изменяется. 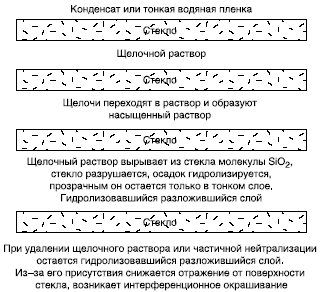 Рис. 12. Схема взаимодействия стекла и влаги воздуха (с водой в недостатке) Особая форма разрушения листового стекла — так называемые нитяные кристаллы,
или “воронья лапа”, которые образуются при реакции кислых оксидов воздуха
(СО2 и SO2) со щелочами, высвободившимися при разложении стекла. Нитяные
кристаллы состоят из карбонатов. Данные кристаллы, выросшие ориентированно
в соответствии с направлением вытягивания стекла, показаны на рис. 13.
Они появляются при условии, что стекло сначала увлажняется, а потом высыхает.
Часто их можно наблюдать еще до первого помутнения. Они свидетельствуют
о начале разложения, хотя еще и не являются дефектом поверхности стекла,
а лишь предупреждают о возможности его появления.  Рис.13. Нитяные кристаллы или “воронья лапа”, образовавшиеся в различных условиях взаимодействия стекла с оксидами воздуха (СО2 и SО2). Избежать пороков типа “помутнения” и др. в промышленных масштабах можно
путем использования растворов нитрата цинка при повышенных температурах
(60-100°С). Такая обработка стекла должна более чем в 3 раза повысить
устойчивость стекла по сравнению с необработанным. И.А. Кумалагов Кандидат технических наук Продолжение статьи читайте в № 3/2004 «ОКНА. ДВЕРИ. ВИТРАЖИ» |