Самоочищающееся стекло — нанотехнологии и экологичность
Во второй половине ХХ века было разработано множество видов тонких покрытий,
нашедших широкое применение в самых различных отраслях. Но только в 70-е
годы применение покрытий создало новые возможности и коренным образом
преобразило дизайн помещений.
Первичной целью применения покрытий на стекле было обеспечение сокращения
потерь тепла через оконные проемы. Дальнейшие разработки в этом направлении
позволили создать покрытия, обеспечивающие пропускание дневного света
с интенсивностью почти равной стандартному стеклу, но только с половинной
долей солнечной тепловой активности.
При всех этих прогрессивных технологиях все же оставалась одна очень важная
проблема – загрязнение стекол. Любому человеку наверняка хочется, чтобы
его дом беспрепятственно наполнялся дневным светом через чистые сияющие
окна. Но как этого добиться? Сколько ни мой эти стекла, они после первого
же дождя покрываются грязными разводами.
Сравнительно не так давно на строительном рынке появилось стекло, которое
“само себя моет”. Изобретение имеет специальное покрытие на наружной поверхности,
которое способно очищать стекло снаружи от органических и других загрязнений.
Свойства этого материала, нанесенного на стекло, сохраняются более 20
лет.
Прочность нанесенного покрытия достигается специальным производственным
процессом. Микроскопически тонкое покрытие наносится на одну из сторон
стекла и становится неотъемлемой частью его поверхности. Покрытие может
быть повреждено, только если оцарапать или разбить само стекло.
С виду самоочищающееся стекло выглядит совершенно обычно, и грязь оседает
на нем точно так же, как на обычном стекле. Но благодаря тому, что на
его поверхности есть тонкий слой (толщина – 15 нм) двуокиси титана, вступающий
в реакцию с грязью при освещении солнечным светом, это стекло обладает
способностью к самоочищению.
Между самоочищающимся и обычным стеклом есть разница, невидимая с первого
взгляда – они по-разному смачиваются водой. Точнее грязь, осевшая на поверхности
самоочищаемого стекла, в ходе реакции фотокатализа разлагается на растворимые
компоненты, и поверхность “титанового стекла” становится гидрофильной.
Это позволяет дождевой воде легко смывать всю грязь. Ну а малая толщина
каталитического слоя как раз и сохраняет прозрачность стекла, позволяя
нам не замечать его. Для реакции фотокатализа требуется наличие солнечного
света, содержащего в своем спектре ультрафиолет, а катализатором выступает
двуокись титана. (Рис.1)
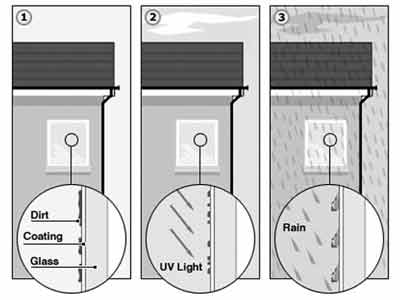
Рис. 1
|
Поверхность покрытия такого стекла имеет два важнейших химических свойства, которые, делают стекло самоочищающимся. Эти свойства получили название фотокаталитического и гидролитического эффектов. |
Фотокаталитический эффект
Фотокаталитический эффект – это химическая реакция, которая проистекает
под воздействием световой энергии в присутствии катализатора. Очень важен
тот факт, что катализатор, стимулируя химическую реакцию, сам в ней не
участвует, то есть не расходуется. В свою очередь органические частицы
грязи, попадающие на поверхность, подвергаются окислению.
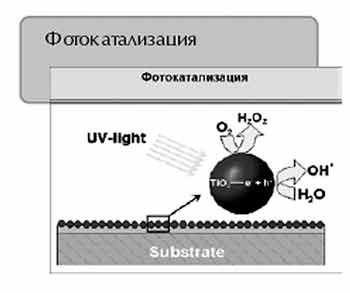
Рис. 2
На современном этапе развития науки фотокаталитический эффект – это “изменение скорости или возбуждение химических реакций под воздействием света в присутствии веществ (фотокатализаторов), которые поглощают кванты света и участвуют в химических превращениях участников реакции, многократно вступая с ними в промежуточные взаимодействия и регенерируя свой химический состав после каждого цикла таких взаимодействий.
|
Под фотокаталитическим эффектом следует понимать накопление солнечной энергии в покрытии, что приводит к выделению активного кислорода. Активный кислород является сильным окислителем. Он способен окислять органические соединения до полного распада, а также убивать бактерии и запахи на поверхности покрытия. Чем не решение экологических вопросов? |
Фотокатализатором может, например, выступать мелкодисперсное соединение
TiO2. В его присутствии реакция идет с высоким квантовым выходом под действием
света, соответствующего спектру поглощения TiO2 (l < 400 нм). Отметим,
что света с такими длинами волн в солнечном спектре много. Таким образом
фотокатализаторы возбуждают химическую реакцию или, другими словами, расширяют
спектр действия системы, т.е. область длин волн света при облучении которым
идет реакция.
TiO2 – полупроводниковое соединение, наиболее распространенными являются
его кристаллические модификации – рутил и анатаз. Причем наибольшей фотокаталитической
активностью обладает TiO2 с кристаллической модификацией анатаз, не содержащей
большого числа примесей.
По современным научным представлениям, в таких соединениях электроны могут
находиться в двух состояниях: свободном и связанном. В первом состоянии
электроны движутся по кристаллической решетке, образованной катионами
Ti4+ и анионами кислорода О2–. Во втором состоянии – в основном электроны
связаны с каким-либо ионом кристаллической решетки и участвуют в образовании
химической связи. Для перевода электрона из связанного состояния в свободное
необходимо затратить энергию не менее 3,2 эВ. Эта энергия может быть доставлена
квантами света с длиной волны l < 400 нм. Таким образом при поглощении
света в объеме частицы TiO2 рождаются свободный электрон и электронная
вакансия (в физике полупроводников такая электронная вакансия называется
“дыркой”).
Электрон и “дырка” – достаточно подвижные образования и, двигаясь в частице
полупроводника, часть из них рекомбинирует, а часть выходит на поверхность
и захватывается ею. Схематически процессы, происходящие на частице TiO2
изображены на рисунке 3.
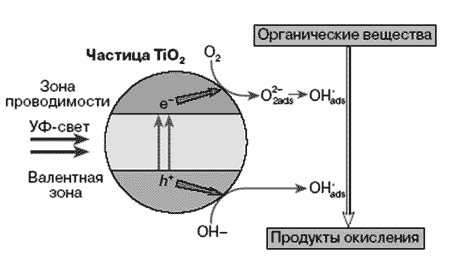
Рис. 3
Захваченные поверхностью электрон и “дырка” являются вполне конкретными
химическими частицами. Электрон — это Ti4+ на поверхности, а “дырка” (электронная
вакансия) локализуется на решетчатом поверхностном кислороде, образуя
О2–. Они довольно реакционноспособны, способность электрона и “дырки”
на поверхности TiO2 характеризуется величинами: потенциал электрона –0,1
В, потенциал “дырки” +3,0 В относительно нормального водородного электрона.
Электрон способен реагировать с кислородом, рождая последовательность
реакций:
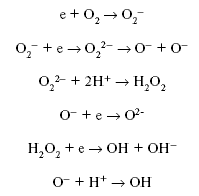
При этом могут образовываться такие мощные окислители, как O– и ОН – радикал. Вторым возможным маршрутом реакций электрона являются реакции:
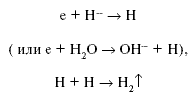
Но второй маршрут реализуется только в водных растворах и при низких
концентрациях кислорода. Основным же каналом исчезновения являются реакции
с кислородом.
“Дырка” реагирует либо с водой
либо с любым адсорбированным органическим (в некоторых случаях и неорганическим) соединением
OH – радикал или О– также способны окислить любое органическое соединение. И таким образом поверхность TiO2 становится сильнейшим окислителем.
|
Таким образом для полупроводниковых частиц как фотокатализаторов обычно рассматривают несколько стадий процесса: |
Гидролитический эффект
Гидролитический эффект – это изменение угла смачиваемости поверхности
покрытия. После достижения определенного накопления солнечной энергии
(активизации) вода не собирается в капли, а растекается по стеклу широкими
ровными слоями, образуя тонкую пленку, и смачивает скопившуюся на поверхности
грязь. Пленка легко соскальзывает с поверхности стекла и полностью смывает
грязь, а затем быстро высыхает, не оставляя разводов.
Этого эффекта можно добиться после накопления солнечной энергии в течение
5-10 солнечных дней. Быстрота активизации зависит от интенсивности солнечного
излучения. После облучения солнечным светом данное покрытие становится
активным и в ночное время, и в пасмурные дни. После активизации поверхность
стекла с самоочищаемым покрытием работает постоянно и даже если солнца
давно не было и все процессы замедлились, при первом его появлении поверхность
быстро набирает прежнюю интенсивность эффектов.
В состав покрытия входит фаза TiO2, степень структурного совершенства
в исследуемых покрытиях оценивается по величине смещенной в низкочастотную
область максимума полосы поглощения антисимметричных валентных колебаний
связей Ti – O – Ti от 950 см–1.
Титан имеет конфигурацию внешней электронной оболочки 3d2 4s2. Близкое
значение энергий 4d, 4s, 4p-орбиталей обуславливает легкость распаривания
4s-электронов с переходом на d- и p-орбиты. При этом реализуется валентное
состояние d3s (энергия перехода d2s2 - d3s составляет 176,6 кДж) и d2sp
(энергия перехода 184,8 кДж).
В связи с большой стабильностью у ионов d-орбиталей по сравнению с s-орбиталями
валентность Ti в ионных соединениях и комплексах при условии отсутствия
p-связей с лигандами может изменяться от 2 до 4. Однако наиболее распространенным
состоянием окисления является TiIV. Различные валентные формы Ti (TiII
и TiIII) легко окисляются до TiIV кислородом воздуха, водой и другими
реагентами.
Обычно в соединениях проявляется наибольшая степень окисления Ti, хотя
в кристаллах возможно наличие (TiII и TiIV ) в виде примесей, влияющих
на значение показателя преломления.
Исходя из данных об электроотрицательности элементов, степень ковалентности
связи Ti-O оценивается в 37% (по сравнению с 50% Si-O и 37% для Al-O).
Титан в решетке рутила имеет не более двух положительных зарядов, а кислород
не более одного отрицательного. Понижение степени окисления Ti приводит
к частичному заполнению 3d-орбиталей электронами и резкому усилению взаимодействия:
наличие частично заполненной 3d-зоны в кристаллах TiO и Ti2O3 (конфигурации
d2 и d), октаэдры TiIIO6 или TiIVO6, в которых соединенные ребрами, проявляется
в резком повышении проводимости вплоть до металлической TiO.
Рентгенофазовый анализ показал, что основной фазой покрытий, полученных
химическим способом, есть TiO2 в виде одной из его модификаций – рутила.
В соответствии с зонной теорией 3d-зона незаполненная. В этом состоянии
рутил есть изолятор с шириной заряженной зоны более 3 эВ. Изменение степени
окисления титана приводит к частичному заполнению 3d-орбиталей и изменению
катион-катионного взаимодействия в формировании кластеров соединений TiO
и Ti2O3 (октаэдры TiIIO6 или TiIVO6).
|
Стоит отметить, что под действием естественного света за 1 ч на поверхности стекла активный слой на основе TiO2 способен разрушить слой органических соединений толщиной 6 нм. За счет продолжительного действия химической реакции на поверхности стекла даже очень большие загрязнения разрушаются и удаляются естественным образом после дождя. |
Стекла с активным слоем, придающим ему эффект самоочищения, можно использовать
практически везде. Они подойдут и для окон, и для оранжерей, и для фасадов
зданий, и для стеклянных крыш, и для недоступных окон, где обычно скапливается
органическая грязь, например, для световых люков. Этот материал просто
идеальный. Стекло может быть установлено и вертикально, и под углом. Не
подойдет оно только для использования внутри помещений.
Несомненно, самоочищающиеся стекла — серьезное достижение в области стекольной
промышленности. Но, как обычно, есть и недостатки. Самоочищающееся покрытие
предотвращает только органические отложения. Оно не функционирует в случае
загрязнения краской, лаком и неорганическими соединениями.
И все же, несмотря на подобные минусы, самоочищающиеся стекла – гениальное
изобретение. Хотя, конечно же, придется периодически вспоминать про ведра
и щетки, но в общем окна с самоочищающимися стеклами будут сохранять чистоту
значительно дольше, чем обычные.
А.В.Маричев, С.А.Попович, А.А.Иванин,
ГП “УкрНИИСтекла”,
ООО НПП “Магнат Плюс”


