Роль химических элементов в стеклообразовании
В неорганических стеклах различают два типа электрохимических связей:
1. Ионные (электровалентные) связи.
При ионной связи элементы (I и II вертикальные ряды) приобретают структуру
инертного газа, отдавая электроны и превращаясь в положительно заряженные
ионы. Ионные связи характерны для элементов, которые в водных растворах
легко образуют электролиты. Для нас важно, что в стекле ионная связь не
участвует в образовании пространственной решетки.
2. Ковалентные связи.
Атомы могут приобрести структуру инертных газов также в случае наличия
общих электронов. Такие связи называются ковалентными, они типичны для
неэлектролитов. Разные виды стекла имеют особенность — в их структуре
наличествуют ковалентные и ионные связи в различной комбинации в соответствии
с количеством тех или иных отдельных элементов, что и определяет в итоге
свойства стекла.
Первую группу элементов образуют элементы инертных газов
(гелий, неон, аргон, криптон, ксенон и радон). Из них только гелий имеет
2 электрона, остальные редкие газы имеют по 8 электронов во внешней оболочке.
Поэтому они и не проявляют стремления к образованию соединений и не являются
составными частями структуры стекла.
Вторую группу образуют элементы, отличающиеся тем, что в
своих внешних предвалентных сферах имеют два электрона как у гелия или
8 электронов как у последующих инертных газов, а поэтому мы называем их
элементами, подобными инертным газам.
В природе они чаще всего образуют силикаты. Из них состоят также наши
обычные технические и промышленные стекла. Только для этих элементов без
больших отклонений справедливо правило аддитивности, и только для них
мы можем рассчитать значения свойств по оксидному составу стекла.
Это возможно потому, что ионы этих элементов в стекле недеформированы
соседними ионами кислорода, занимающими в решетке стекла шаровое пространство
с малоизменяющимся ионным радиусом и не проявляющими полярности.
Между этими классическими стеклообразующими элементами различаем несколько
категорий. Есть между ними анионы и катионы. Из анионов наибольшее значение
имеет кислород, который является партнером для всех катионов, входящих
в состав технического стекла. Почти такой же величины фтор может часто
замещать кислород в стекле. Ион хлора гораздо больше иона кислорода, поэтому
он не может служить строительным материалом в структуре оксидных стекол.
Если мы осветляем стекло хлоридом, в оксидном стекле остаются только следы
хлора, главным образом из-за наличия сырьевых материалов со связанной
водой, вследствие чего осветление стекла хлоридами является выгодным,
особенно в боросиликатных стеклах. Сера также является основной составной
частью оксидных стекол, в которых содержание SO4” доходит обычно до 0,6%.
Углерод в стекле представлен как СО2 в связанном виде, причем имеются
только его следы. Азота в оксидной форме в стекле еще меньше. Таким образом,
в оксидных стеклах любые анионы (за исключением фтора, главным образом
из-за своего большего размера по сравнению с кислородом), не применяются
в качестве структурообразующих составных частей.Между катионами этой группы
находим, прежде всего, элементы, которые легко образуют ионы с одним или
двумя зарядами (одновалентные и двухвалентные элементы). Эти элементы
легко образуют электролиты в водных растворах. Это щелочные и щелочноземельные
элементы. Обе группы применяются в стекловарении в качестве плавней. Оксиды
этих одновалентных и двухвалентных элементов (Na2O, K2O) не могут сами
образовывать одновалентные стекла. Их химические связи являются ионными
связями (электровалентыми). Если мы изменим их количество и соотношение
в стеклах, эти элементы изменят свойства стекла. Поэтому с точки зрения
структуры называем их модификаторами.
Одновалентные элементы проявляют малую прочность связей с кислородом,
они непрочно связаны в структуре стекла и являются причиной электропроводности
стекломассы. Они не только выщелачиваются из стекла (водой, кислотами,
спиртом), но и достаточно легко отдают кислород соответствующим соседним
элементам, имеющимся в изобилии вокруг них в структуре стекла для достижения
наиболее равномерного распределения кислорода между катионами и для того,
чтобы структура стекла была более цельной. Двухвалентные элементы Be,
Mg и Са, наоборот, прочно связаны с кислородом, а там, где отсутствуют
щелочи, отдающие кислород (в глиноземистых бесщелочных или боросиликатных
малощелочных стеклах и у стекол с высоким содержанием магния), приводят
к захвату кислорода и способствует тому, что стекло расслаивается по меньшей
мере на две микрофазы при низких температурах.
Основное свойство этих элементов состоит в том, что они реагируют в одной
постоянной валентности. Координационные группировки кислорода вокруг этих
катионов, конечно, переменны и у щелочных элементов зависят не только
от состава стекла, но и от его теплового прошлого. Достаточно сказать,
что именно это обстоятельство способствует тому, что стекло, нагретое
до температуры трансформации, сжимается, что может влиять на точность
мерных колб, вырабатываемых из такого стекла.
Чем выше содержание щелочных оксидов в щелочно-известковом стекле, тем
больше в нем будут преобладать ионные электровалентные связи, которые
препятствуют образованию структуры стеклообразующими элементами и тем
больше образуется в стекле островков со структурой, которая более ориентирована
по сравнению с окружающим веществом, что проявляется, например, в повышении
расщепляемости стекла. Эта склонность была использована в знаменитых мягких
итальянских мозаиках, применявшихся в средиземноморских странах в эпоху
Древнего Рима и Средневековья.
Особо должны быть выделены в этих группах элементы Si, B и P. Известно,
что их оксиды существуют в стекловидном состоянии. Их ионы очень малы
и сгруппированы с четырьмя ионами кислорода. Они образуют тетраэдры, пространственные
решетки которых являются каркасами структуры стекла. В водных растворах
они не диссоциируются и поэтому не образуют ионных связей, как ранее упомянутые
модификаторы, а лишь ковалентные связи. Имеется очень мало элементов,
оксиды которых могут существовать в стеклообразном состоянии (B, Si, P,
Ge, Sb, As). Прочность решетки в стекле увеличивается с увеличением заряда
(валентности) и уменьшается с увеличением радиуса иона; малый ион кремния
с большим зарядом (Z = 4) прочно связывает анион кислорода.
Ионные потенциалы отношения валентности к ионному радиусу имеют практическое
значение для рассмотрения зависимости между элементами одного и того же
вида, например, между сеткообразующими элементами.
Ионный потенциал z/r бора равен 15, фосфора 14,7, а кремния 9,8. Так как
ионный потенциал бора и фосфора выше, чем у кремния, SiO2 растворяется
в B2O3 и в Р2О5. Становится понятным, почему соединения бора служат отличными
плавнями, несмотря на то, что он не создает электровалентных ионных связей.
Только более высокий ионный потенциал бора делает возможным образование
стекломассы у стекол с высоким содержанием SiO2 (80%).
Способность элементов периодической системы образовывать оксидные однокомпонентные
стекла зависит от радиуса их ионов. Радиус должен быть таким, чтоб в пространстве
вокруг катиона анионы (в случае кислородных стекол — ионы кислорода) могли
бы сгруппировываться в тетраэдры. Отношение радиуса катиона к радиусу
кислорода должно лежать в пределах от 0,225 до 0,414.
По требованиям, вытекающим из стереометрии, строение стекловидных материалов
в группе элементов, подобных редким газам, могут создавать только упомянутые
три элемента (кремний, бор, фосфор).
Из III группы элементов, отличных от инертных газов, удовлетворяет данному
требованию германий, который по своим стеклообразующим свойствам в значительной
степени уподобляется кремнию. В конце этой четырехчленной группы сеткообразователей,
способных соединять свои структурные пространственные единицы (преимущественно
тетраэдры, или у трехкоординационного бора треугольные пластинки) в связную
сетку, стоят мышьяк и сурьма. Хотя эти два элемента по соотношению радиусов
ионов не соответствуют вышеприведенному геометрическому правилу, в их
оксидах, тем не менее, ионы кислорода размещены вокруг центрального катиона
в двух случаях так, что уподобляются конфигурации кремния, и эта пространственная
аналогия является причиной того, что оксид мышьяка известен как стеклообразующий.
Однако эти оксиды не распределены по структуре силикатных стекол в более
или менее заметной степени, имеются только следы их, так как они вводятся
только для осветления.
Кремний окружен четырьмя ионами кислорода, образующими в пространстве
тетраэдр. При таком расположении можно ожидать, что каждый двухвалентный
кислород, находящийся в вершине тетраэдра, связанный одной валентностью
с центральным кремнием, будет другой валентностью связан со следующим
тетраэдром. Таким образом, он является мостом между двумя тетраэдрами:
поэтому можно говорить о «мостовом» ионе кислорода.
Прочность связи между кремнием и кислородом очень велика (отсюда высокая
температура плавления SiO2). При охлаждении изделия стекломасса в пластическом
состоянии не успевает потерять эту прочную химическую связь и создать
новую, упорядоченную, требуемую для кристаллизации. Структурное состояние
пластического материала, приближающееся к состоянию жидкостей, «замерзнет».
Таким образом, в твердом состоянии, материал не перейдет в упорядоченное
кристаллическое состояние, сетка SiO2 в стекле энергетически почти также
стабильна, как и в кристаллическом упорядоченном состоянии. При обычной
температуре образуется стабильное стекло, как это известно из повседневной
практики.
Среди элементов-сеткообразователей особое положение занимает бор. Свойства
боросиликатных стекол значительно меняется в зависимости от содержания
B2О3 в стекле и прочих катионов, особенно щелочей.
По составу этих стекол нельзя заранее предугадать их свойства: правило
аддитивности здесь не действительно. Это обстоятельство называется «борной
аномалией» и имеет отношение к его положению в периодической системе,
к его электронным оболочкам. С точки зрения классической химии бор стоит
среди элементов, подобных редким газам; на границе между классическими
элементами — металлами литием и бериллием и неметаллами (углерод и азот).
Его атом имеет два электрона во внутренней сфере и три электрона в валентной
сфере.
Однако «связь» бора с внешними валентными электронами не так мала, чтобы
его типичной формой был трехвалентный катион В3+ (после утраты валентных
электронов), и недостаточно велика, чтобы ион образовал устойчивое образование,
в котором он был бы окружен восемью электронами (электронный октет).
Бор в стекле, в зависимости от обстоятельств, бывает окружен тремя ионами
кислорода (такая конфигурация имеет относительно небольшую химическую
устойчивость, снижает вязкость, повышает тепловое расширение) или четырьмя
ионами кислорода, которые в этом случае окружают его в тетраэдре, подобном
тетраэдру кремния (такая конфигурация имеет большую прочность химической
связи, вязкость повышается, тепловое расширение уменьшается). Поэтому
возникает большое различие в его влиянии на физические свойства стекла.
Это проявляется в некоторых стеклах и является одной из причин, почему
именно боросиликатные стекла имеют склонность к расслоению в определенном
интервале низких температур (обычно между 500-780°С).
В конце немногочисленной группы стеклообразователей (из наиболее распространенных
и доступных элементов для производства стекла применяется только кремний)
стоят элементы-сеткозаполнители.
В стекле эти элементы окружены также четырьмя ионами кислорода и также
образуют тетраэдр, как кремнезем, замещают его даже в связной пространственной
решетке стекла, однако сами не могут образовывать однокомпонентное стекло.
Глинозем, к примеру, неизвестен в стекловидном состоянии без других компонентов.
Соотношение радиусов ионов элементов-сеткозаполнителей и кислорода превышает
или доходит до 0,414.
Следовательно, положение стеклообразующих и сеткозаполняющих элементов
в периодической системе определяется размером их ионов, возможностью группировки
вокруг них четырех ионов кислорода с образованием тетраэдра и прочностью
связи катион-кислород.
С точки зрения классической химии и распределения в периодической системе,
мы видим, что сеткообразователи лежат в группе металлов с правой стороны
на самой границе с неметаллами, например, В/С или Si, P/S, менее вероятно
Ge/As, хотя здесь речь идет о группе элементов, неподобных инертным газам.
Сеткозаменяющие элементы лежат от них налево, посредине между сеткообразующими
и модификаторами. Сеткообразующие элементы должны иметь большие числа
валентных электронов (от 3 до 5), сеткозаменяющие несколько менее — от
2 до 3. У сеткообразователей ковалентность связи более ярко выражена,
чем у сеткозаполняющих элементов.
Число ионов кислорода, сгруппированных вокруг катиона, является у сеткообразующих
элементов числом-постоянным (координационное число = 4), у сеткозаполняющих
элементов оно может быть разным.
Необходимо отметить интересное явление — по направлению в таблице вправо
возрастает валентность (заряды), а с ней и ковалентность связей, которые
ведут к стеклообразованию, в то время как в вертикальных группах вниз
возрастает размер ионов. Комбинация обоих этих принципов приводит к тому,
что по диагонали элементы проявляют родственные свойства и сходство.
Для примера скажем, что литий и магний в боросиликатных стеклах снижают
диэлектрические потери, бериллий и алюминий повышают химическую стойкость
стекол, бор и кремний являются элементами-сеткообразователями.
Между сеткообразующими и модифицирующими элементами стоит переходная группа
элементов, которые в структуре стекла могут частично заменять тетраэдры
кремния. Хотя они и принимают участие в построении сетки стекла, их оксиды
сами не могут образовать однокомпонентное стекло.
Третью группу образуют элементы, которые во внешней сфере имеют
не 8 электронов, а 18. Они не уподобляются элементам инертных газов и
многим отличаются от предыдущей второй группы.
Они отличаются от классических стеклообразующих элементов второй группы
своим влиянием на свойства стекла, а при аддитивных расчетах дают более
значительные отклонения от измеренных величин. В классическом оформлении
периодической системы эти элементы составляют второстепенные ряды вертикальных
групп. Они отличаются гораздо более ярко выраженными ковалентными связями,
чем их партнеры в главных рядах. Их общей чертой является то, что в присутствии
сеткообразующих элементов кремния, бора, фосфора или элементов с высокой
прочностью связи с кислородом (титан) они могут образовывать двухкомпонентные
стекла и в тех группах, где сеткообразующие элементы не могут образовать
связную сетку. Вероятно между тетраэдрами кремния создаются мосты, возникают
и схематические связи как — O — Si — Pb — O — Si — O.
Так как они проявляют гораздо меньшее стремление к ионизации, они образуют
ковалентные связи и способствуют созданию «молекулярных» образований,
насколько можно говорить о молекулярных образованиях в стекле. Так как
сила связи между молекулами меньше ионной связи, сильно снижается вязкость.
Наглядным примером является влияние оксида свинца на снижение вязкости.
Следующей характерной чертой является полярность их ионов. Это означает,
что если к ионам приблизится анион кислорода в структуре стекла, в нем
возникает деформация электронной оболочки в том смысле, что центр орбит
электронов не совпадает с центром их ядра. Это приводит к тому, что молекула
их оксидов становится несимметричной, что для стекол, содержащих эти оксиды,
дает ряд следствий.
Вследствие асимметрии на стыковой границе двух фаз снижается поверхностное
натяжение, улучшается поверхностная гигроскопичность и повышается прочность
спая стекла с металлом, так как создается определенный мост между связью
ионов в стекле и связью ионов в металлическом кристалле. Кроме того, элементы
третьей группы действуют как металлизаторы, повышают растворимость металлических
элементов в стекле (например, при образовании золотого и медного рубина).
Стабильность ионов с электронной структурой, отличающейся от структуры
инертных газов, гораздо менее значительна, чем в предыдущей группе. Главным
образом у ионов первых трех элементов (Cu, Ag и Au), у которых внешняя
сфера заполнена 18 электронами, распределение внешних электронов нестабильно.
Один или несколько электронов может оторваться и создать ион с разной
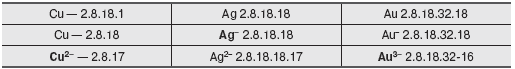
устойчивостью. Нижеприведенная триада (таблица 1) образует такие ионы
(из них подчеркнуты наиболее устойчивые).
Cu, Ag и Au образуют одну группу, очень важную в стеклоделии, так как
способность этих элементов легко менять свою валентность связана с их
способностью образовать технические и художественные светочувствительные
стекла.
Другую определившуюся группу образуют Zn и Cd. Оба этих элемента только
двухвалентны. Все 18 электронов внешней сферы прочно связаны. В стекле
они отличаются общим свойством образовать бесцветные комплексы с серой,
что практически используется в технологии стекла для получения бесцветного
хрусталя, либо для обесцвечивания стекол, окрашенных сульфидами и селенидом
кадмия.
Одна только ртуть, стоящая во II вертикальной группе периодической системы
элементов, не связана с точки зрения стеклоделия как конечный член триады
с предыдущими элементами Zn и Cd. Ее особое положение и свойства прогнозируем
из родства с элементами IX горизонтального ряда 6-го большого периода.
Называем их также «тяжелыми» элементами. Сюда относятся Hg, Tl, Pb, B.
Они, как Zn и Cd имеют во внешнем слое 18 электронов, однако электроны
в валентном слое расположены на двух подуровнях. Первые два электрона,
лежащие на внутренних орбитах, более прочно удерживаются ядром, и атом
неохотно их отдает. Называем их инертной парой. Они находятся в положении,
обозначенном 6-s. Электронам, вращающимся в какой-либо сфере в орбитах
типа s, приписываем особую стабильность. В переводе на язык классической
химии, это означает, что, например, атом свинца при потере двух внешних
электронов из орбит ? относительно легко переходит в двухвалентный ион,
однако труднее теряет два последующих валентных электрона пары из орбит
s и уже менее легко создает четырехвалентный ион. При приближении в структуре
стекла иона кислорода, несущего отрицательный заряд, электроны инертной
пары отталкиваются на другую сторону ядра иона свинца, что вызывает пространственную
деформацию всего иона, которая связана, например, со снижением поверхностного
натяжения, снижением модуля упругости, повышением показателя преломления,
снижением вязкости и т.д.
Аналогичные свойства сообщает стеклу и висмут Bi (по сравнению с Pb и
U наиболее снижает пропускание рентгеновских лучей) и железо Fe (применяется
для производства стекол с высоким показателем преломления). Действие инертной
пары электронов проявляется также у In, Sn, Sb, As, но в несколько меньшей
мере. Вероятно, чем выше содержание данного иона, тем больше правдоподобность
того, что он одновременно служит и модификатором, и участником образования
сетки, т.е. сеткозаполнителем.
Следует упомянуть еще о двух деталях этой группы элементов. Элементы Ag,
Au, Cu, Tl, Pb, Bi, In, Sn, Sb, As проявляют в стеклах одинаковые свойства;
легкую восстанавливаемость, например, водородом при высокой температуре,
что приводит к созданию низшей валентности.
В IX горизонтальном ряду возрастает стабильность высшей валентности слева
направо: Pb2 более стабилен, чем Pb4, в то время как Bi стабилен в трехвалентной
форме. В начале ряда стоит ртуть, как элемент, находящийся во II вертикальной
группе, она способна образовать ионы Hg2, как член IX горизонтального
ряда, она проявляет, однако, свойства, характерные для Tl-Pb-Bi, а именно,
переходить с более высокой валентности на низшую, более устойчивую, т.е.
валентность ниже двух. У двухвалентной ртути валентность два является
наивысшей.
При потере двух электронов в позиции 6-s образуется стабильный нейтральный
атом без взаимного химического средства. Этим ртуть уподобляется далеко
расположенным редким газам с нулевой валентностью и проявляет некое химическое
сродство. Ртуть является жидким металлом с низкими точками плавления и
кипения и так же, как ее соединения, при температуре плавления стекла
полностью улетучивается и не может поэтому стать составной частью структуры
стекла.
Четвертую группу поставляют переходные элементы в 4-м большом периоде
(Se вплоть до Ni) и в 6-м большом периоде (La вплоть до Te). Эти элементы
обладают поляризационной способностью, еще более ярко выраженной, чем
у элементов, неподобных редким газам. Они могут выступать в разных валентностях,
например, Te, Mn, Mo, в стекле имеют, как правило, две валентности и их
равновесие зависит от состава основного стекла и условий варки. Элементы
этой группы являются парамагнитными металлами. Их соединения имеют сильную
тенденцию выступать в качестве красителей. В стекле они применяются как
сильные минерализаторы (Pt, Pd, W).
И в этой группе мы находим подгруппы элементов со сходными свойствами.
Ti и Zr образуют одну такую подгруппу сеткозаполняющих элементов, отличающихся
повышением химической устойчивости стекол.
По электронной конфигурации ванадий V сходен с Ti. Оба они находятся в
IV горизонтальном ряду. В группе Cr, Mo, W, U можно констатировать снижение
поверхностного натяжения, но в технических стеклах только Mo и W проявляют
ближайшее сходство. Mn, Cr и группа Fe-Co-Ni образуют группу издавна применяемых
элементов для окрашивания стекол. Особую группу, резко отличающуюся среди
переходных элементов, образуют металлы платиновой группы, которые в последнее
время нашли применение для образования центров кристаллизации в технических
стеклах.
Следует заметить, что в группе переходных элементов наилучшими красителями
стекол являются элементы первого ряда, у которых внешние электроны находятся
в положении 4s, уран (положение 7s) и редкоземельные элементы (положение
6s), а также элементы Ag, Cu, Au. Известно, что в позиции s находятся
электроны, относительно прочно связанные с ядром. Все приведенные элементы
обладают способностью окрашивать стекло, имеют внешние электроны в положении
s, например, Ва (6s). Следует добавить, что окрашивать стекло могут только
те элементы, которые по структуре электронных оболочек не подобны инертным
газам, т.е. элементы со значительной полярностью. Чем яснее выражена эта
несхожесть, тем сильнее окрашивающее действие элемента. Поэтому окрашивающие
элементы мы находим только среди переходных и редкоземельных элементов,
лежащих далеко от элементов II группы. В третьей группе мы находим только
три окрашивающих элемента: серебро, золото, медь.
Переходные элементы других двух нижних рядов также окрашивают стекло (например,
молибден, вольфрам, иридий) и придают темные окраски: от синей до черной.
Элементы и аберрантные группы находятся посредине между элементами, подобными
инертным газам, и между переходными элементами. Они стоят ближе к первой
группе, они входят в структуру стекол (например, Pb, Zn). Общей чертой
с переходными элементами является подверженность деформации, которая,
однако, недостаточно велика, чтобы вызвать явление расслоения. У аберрантных
элементов III группы электроны принимаются во внешнюю среду (следовательно,
аналогично группе элементов, подобных инертным газам, отличаются от них
только тем, что в предвалентной сфере у них имеется 18 электронов вместо
8). Переходные элементы IV группы принимают электроны не во внешний валентный
слой, а в предвалентный, чем в корне отличаются от групп II и III.
Пятую группу образуют редкоземельные элементы. Все они трехвалентны
и имеют сходную молекулярную рефракцию. Во многом они сходны с предыдущими
переходными элементами. Они также парамагнитны, отличаются способностью
придавать стеклу окраску. Световая энергия, однако, поглощается не электронами
внешней сферы, а электронами внутренних сфер, которые защищены внешними
сферами от действия внешних сил. С этим, например, связано то, что у
редких земель их окраска в меньшей степени зависит от состава основного
стекла, чем у переходных элементов.
Катионы (преимущественно с этими элементами) могут также образовать стекла,
особенно когда речь идет о катионах соседних вертикальных рядов с ковалентным
характером связей. 7-я группа галогенов с трудом образует однокомпонентные
стекла, легче всего это происходит у них с переходными элементами или
элементами, неподобными инертным газам. Причем, чем выше полярность у
обоих реагентов, тем легче происходит образование стекла.
Проведенные исследования по классификации участия химических элементов
периодической системы Д.И. Менделеева помогут прогнозировать синтез стекол,
моделировать его свойства, обеспечивающие более широкое применение данного
материала в различных областях техники.
Таблица 1
В.И. Борулько, П.В. Борулько, А.В. Маричев,
ГП «УкрНИИСтекла»,
г. Константиновка Донецкой обл.,
Б.И. Середа, В.Ю. Бедаха
ООО «Стекло-Украины ЛТД», г. Одесса