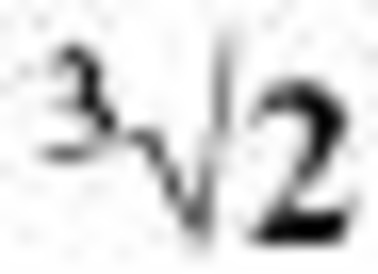Технология клееных стеклопакетов. Окончание
Воздействие кислот
Избыток водных растворов кислот
Уравнение (8) характеризует процесс кислотного воздействия: замена ионов
щелочных металлов с образованием силаноловых групп. Чтобы устранить, по
мере возможности, выделение рассматриваемых ионов, например, из лабораторной
посуды, которое может послужить серьезной помехой при выполнении аналитических
работ, применяют способ выщелачивания посуды с помощью горячих кислот
(“старение” лабораторной посуды).
Горячая концентрированная фосфорная и фтористоводородная кислоты способны
разрушить стекло, воздействуя на него в любой концентрации, вследствие
образования легко растворимых соединений с ионом кремния. Подобным же
образом реагирует борофтористокремниевая кислота.
Химическое травление, преимущественно посредством растворов, содержащих
плавиковую кислоту или щелочи, повышает и механическую прочность стекла
благодаря устранению дефектов поверхности.
Воздействие газообразной среды
Следы кислых газов всегда возникают в той зоне, где сжигаются твердое
топливо, горючие газы или мазут. Тяжелое топливо содержит заметное количество
серы, которая при горении образует оксиды. Действию высоких температур
подвергается каждое изделие из стекла с момента его формования, а также
при отжиге. Щелочные ионы реагируют, прежде всего, со следами кислот и
кислотными ангидридами печной атмосферы, особенно с оксидами серы и углекислотой.
Реакция в присутствии следов влаги для SO2 может быть представлена следующим
образом:
Этим путем образуются соли, создающие сернистый налет на поверхности
изделий. Поскольку в этом процессе щелочи в поверхностном слое стекла
нейтрализуются, то данный налет играет роль защиты поверхности при отжиге.
Снижение доли мазута как топлива стекловаренных печей и переход на электрические
печи отжига стекла исключают процесс образования сернистого налета.
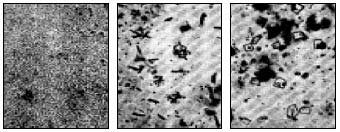
Рис.14. Микрофотографии сернистого налета в различных стадиях, закристаллизовавшегося под воздействием влаги воздуха
Газообразные продукты способствуют получению большей частью натриевых соединений на поверхности стекла, которые легко растворяются в воде. Поэтому данный налет на изделиях вообще не следует рассматривать как порок — его легко устранить промывкой водой. Сернистый налет может изменить свой внешний вид в результате перекристаллизации или гидратации, в частности, благодаря влажному воздуху; иногда для начала перекристаллизации достаточно той влаги, которая сообщается стеклу при прикосновении к нему рукой. На рис. 14 представлены микрофотографии сернистого налета, который закристаллизовался под действием влаги выдыхаемого воздуха.
Воздействие щелочей
В естественных условиях щелочные реакции возможны лишь тогда, когда ионы
гидроксила, реагирующие при недостатке влаги, отбираются в соответствии
с уравнением (11) и действуют как щелочи. Воздействие щелочей в избытке
возможно лишь при специально создаваемых условиях.
Избыток щелочей
Под действием щелочей связи Si-O-Si кремнекислородного каркаса стекла
разрушаются из-за реакций растворения, протекающих по уравнениям (9) и
(10). С ростом температуры и концентрации ионов ОН- процесс усиливается
вначале экспоненциально, позже — линейно (рис. 15). Указанный механизм
имеет место при рН=10.
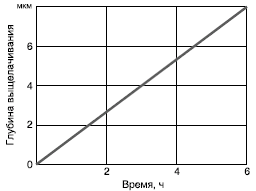
Рис. 15. Зависимость глубины выщелоченного слоя от длительности обработки боросиликатного стекла щелочами (1 N раствор NaOH, Т=100°C)
Недостаток щелочей
Такие реакции встречаются, когда первоначально нейтральная среда вследствие
поглощения ионов ОН- становится щелочной. Этот случай уже подробно рассмотрен
ранее.
Специфика химических взаимодействий поверхности флоат-стекла
Состав флоат-стекла и шихты, используемой для его варки, принадлежит к
группе классических литых и тянутых стекол, для осветления которых обычно
применяют сульфат натрия.
Контакт горячей стекломассы с расплавом олова и с восстановительной атмосферой
ванны в нормальных условиях не влияют на качество готового стекла, хотя
состав поверхности стекла заметно отличается от основной его массы. Между
имеющимися в составе стекла Na2SO4, а также содержащимся в защитной атмосфере
флоат-ванны водородом (10%) и расплавом олова идут химические реакции
с выделением летучих соединений: SnS, Na2S и H2O. В результате этих реакций
поверхность стекла, обращенная к защитной атмосфере ванны, обедняется
ионами Na+, Ca2+, Mg2+, (SO3)2–.
Вынос Na+ с поверхности, контактирующей с расплавом олова, облегчается
тем, что в противодиффузии участвует некоторое количество олова в виде
Sn2+. С обеих сторон ленты в очень сухую атмосферу флоат-камеры выделяется,
кроме того, часть химически растворенной в стекле воды. Изменения состава
ограничиваются толщиной поверхностного слоя стекла от 0,01 до 0,02 мм
и зависят от продолжительности пребывания стекла во флоат-ванне, а следовательно,
они увеличиваются с повышением толщины стекла. Различия в составе шестимиллиметрового
стекла по толщине ленты приведены в таблице 1.
Таблица 1. Различие в химическом составе по толщине ленты флоат-стекла
| Стекло |
SiO2
|
Al2O3
|
Fe2O3
|
TiO2
|
CaO
|
MgO
|
Na2O
|
K2O
|
SO2
|
SnO2
|
| Верхний слой |
74.14
|
0.69
|
0.08
|
0.02
|
8.40
|
3.47
|
12.95
|
0.17
|
0.08
|
—
|
| Средние слои |
72.79
|
0.67
|
0.08
|
0.02
|
8.76
|
3.56
|
13.72
|
0.17
|
0.23
|
—
|
| Слои у расплава олова |
72.79
|
0.66
|
0.07
|
0.02
|
8.79
|
3.55
|
12.85
|
0.17
|
0.11
|
0.88
|
Кандидат технических наук